주요 연구성과
NEW 윤태종 교수팀, 나노 유전자 편집 기술 활용 췌장암 치료제 개발
- 2022-01-07
- 4359

아주대 약학과 윤태종 교수 연구팀이 나노 유전자 편집 기술을 활용해 췌장암 치료제를 개발하는 데 성공했다. 이에 기존 췌장암 치료제에서 치료 효과를 보지 못한 환자들을 위해 활용될 수 있을 전망이다.
윤태종 교수(약학과, 사진)는 나노 입자 전달체에 두 가지 서로 다른 특성을 갖는 유전자 가위 단백질 소재를 탑재하는 방식을 통해 두 가지의 유전적 이상 부위를 동시에 효과적으로 편집함으로써 새로운 췌장암 치료제를 개발하는 데 성공했다고 밝혔다. 관련 내용은 저명 학술지 <바이오머티리얼즈(Biomaterials)> 11월12일자 온라인판에 게재됐다. 논문의 제목은 ‘약물 내성 췌장암 치료를 위한 원샷-이중 유전자 편집(One-shot dual gene editing for drug-resistant pancreatic cancer therapy)’이다. 조영석 가톨릭대 교수(의과대학 소화기내과)도 연구에 참여했다.
연구팀이 개발한 치료제는 유전자 변이로 인해 현재 췌장암 치료제로 널리 사용되고 있는 약물(젬시타빈, Gemcitabine)에 저항성을 보이는 환자들을 위한 것이다. 젬시타빈은 뉴클레오시드 화합물로, 췌장암 세포 안에 흡수되어 유전자에 삽입됨으로써 암 세포의 성장을 억제해 췌장암 환자 치료에 널리 사용되어 왔다. 그러나 췌장암 환자의 약 55% 정도는 두 유전자(KRAS, P53)에 동시 변이가 있어 젬시타빈 약물로 치료 효과를 보기 어렵다. 때문에 췌장암은 사망률 1위에 해당하는 치료가 어려운 질병으로 남아 있다.
윤태종 교수 연구팀은 유전자 가위 기술을 이용해 새로운 췌장암 치료제를 개발했다. 유전자 가위 기술로 암세포의 유전자 변이 부분을 효과적으로 편집해 냄으로써 치료 효과를 높이는 방법이다. 연구팀은 그동안 유전자 가위 기술의 한계로 남아 있던 유전자 가위 단백질 소재의 혈관 내 분해 문제를 해결해 냄으로써 새로운 췌장암 치료제 개발에 성공했다. 그동안 치료제에 사용되는 유전자 가위 단백질 소재가 혈관 내에서 분해되면서 암 세포에 전달되기 어렵다는 점이 유전자 가위 단백질 소재 치료제 연구에 한계로 작용해 왔기 때문.
연구팀은 이같은 한계를 극복하기 위해 단백질 형태의 유전자 가위 물질을 나노 캐리어(LNP, 인지질 화합물로 이뤄진 150나노미터 크기의 구형체 입자로 내부에 다양한 물질을 탑재할 수 있고 생체 적합성이 우수)에 탑재하는 경우 매우 안정적으로 혈관 내에 존재하게 되고, 결국 암 세포에 표적 전달이 가능하다는 점을 활용했다. 이 방법을 이용하면 하나의 나노 캐리어 나노 입자에 두 가지의 유전자 변이(KRAS, P53)를 동시에 편집할 수 있으며, 치료 효과를 극대화할 수 있다.
연구팀은 나노 캐리어 표면에 췌장암 표적을 위한 항체를 도입, 표적 항암제와 유사하게 췌장암 세포에만 유전자 가위 소재를 전달했다. 그리고 이 경우 부작용이 최소화되고 치료 효과를 극대화할 수 있음을 확인했다. 생체 내 실험(in vivo)에서 암 조직으로의 유전자 가위 소재 전달 효율은 60%에 달했으며, 동물 모델에서의 치료 효과도 대조군 대비 높았다.
나노 캐리어(LNP) 기술은 최근 코로나19 백신 개발에 활용되면서 빠르게 검증된 바 있다. 이에 윤태종 교수 연구팀은 이를 유전자 가위 기술에 접목함으로써 새로운 췌장암 치료제를 개발할 수 있었다. 나노 캐리어(LNP) 기술은 그동안 많은 연구가 진행되어 왔지만, 그 안정성에 대한 연구가 정체되면서 관련 연구 개발이 한계에 부딪혀 왔다. 그러나 최근 코로나 펜데믹으로 화이자와 모더나가 개발한 mRNA 탑재 나노 캐리어(LNP)의 나노 독성이 응급 임상 시험 가이드에 의해 빠르게 검증되면서 새로운 국면을 맞이했다.
윤태종 교수는 “코로나19 백신이 빠르게 개발될 수 있었던 결정적 계기는 혈관 내에서 mRNA가 분해되지 않고 안정적으로 유지될 수 있게 하는 나노 캐리어(LNP) 기술의 접목”이라며 “단백질 형태의 유전자 가위 물질 역시 혈액 내에서 분해되기 쉬운 물질로 생체 내 전달 효율이 낮아 암치료제 개발에 어려움이 있었다”고 설명했다.
그러나 새로이 개발된 나노 캐리어(LNP) 기술을 접목함으로써 유전자 변이에 따른 항암제 내성을 갖는 질병을 치료할 수 있는 방법을 찾게 되었다는 설명이다. 유전자 가위 기술을 이용한 치료제 개발에서 가위 역할을 하는 단백질 구조체는 혈액 내 안정성이 떨어진다. 이에 그동안 시험관 환경(in vitro) 또는 직접 주사 방식을 적용하는 질환에만 활용이 가능했다.
윤태종 교수는 “이제 유전자 가위 기술에 나노 캐리어(LNP) 기술을 접목함으로써 혈관 주사를 활용하는 방안이 가능해졌다”며 “보다 다양한 질병의 치료에 이를 적용할 수 있게 되어, 나노-유전자 편집 기술의 활용 범위가 확장될 수 있을 것으로 기대한다”고 덧붙였다.
윤태종 약학과 교수는 지난 20여년 간 다양한 바이오 물질을 효과적으로 세포나 조직에 전달할 수 있는 나노 바이오 분야를 연구해왔다. 최근에는 유전자 가위 기술의 한계로 지적되어 온 ▲낮은 체내 안정성과 세포 침투율 ▲국부 치료가 불가능하다는 문제점 등을 극복하고자 나노 기술을 접목하는 연구에 집중해 왔다. 윤 교수는 아주대학교 산학협력단 산하 엔포유기술지주회사의 자회사인 ㈜무진메디의 대표를 맡고 있다. 연구팀은 이 회사를 통해서 임상 시험을 진행할 계획이다.
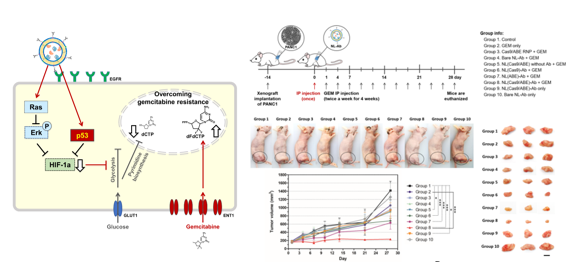
연구팀은 항암제 내성을 갖는 췌장암 동물모델에 LNP-유전자 가위 치료제를 혈관 주사한 이후, 젬시타빈 항암제를 병용 투여하여 치료 효과를 확인했다.
